研究に関する記事を書こうとすると、事実に基づいてできるだけ正しく記述しようとするために、当時の論文を読み直すなどかなり手間がかかる。一方で、専門用語を使った難しい(ほとんどの人には理解できない)内容になるために、多くの方にはあまり興味をもってもらえない。そのことが分かっていながら、今回は自分の最高傑作だと思っている実験内容を紹介したい。このような記事を書き残しておくことが、このホームページの独自性と価値を高めるだろうと私は勝手に考えている。
与えられた実験環境で、自分の知識と技術を限界まで使ったベストパフォーマンスの実験だったと今でも自負している。35年以上経った今でもその内容に自信を持ち続けられたから、研究者としてやってこられたのだと思う。一般の方には雰囲気を感じてもらうだけになると割り切って書くことにする。
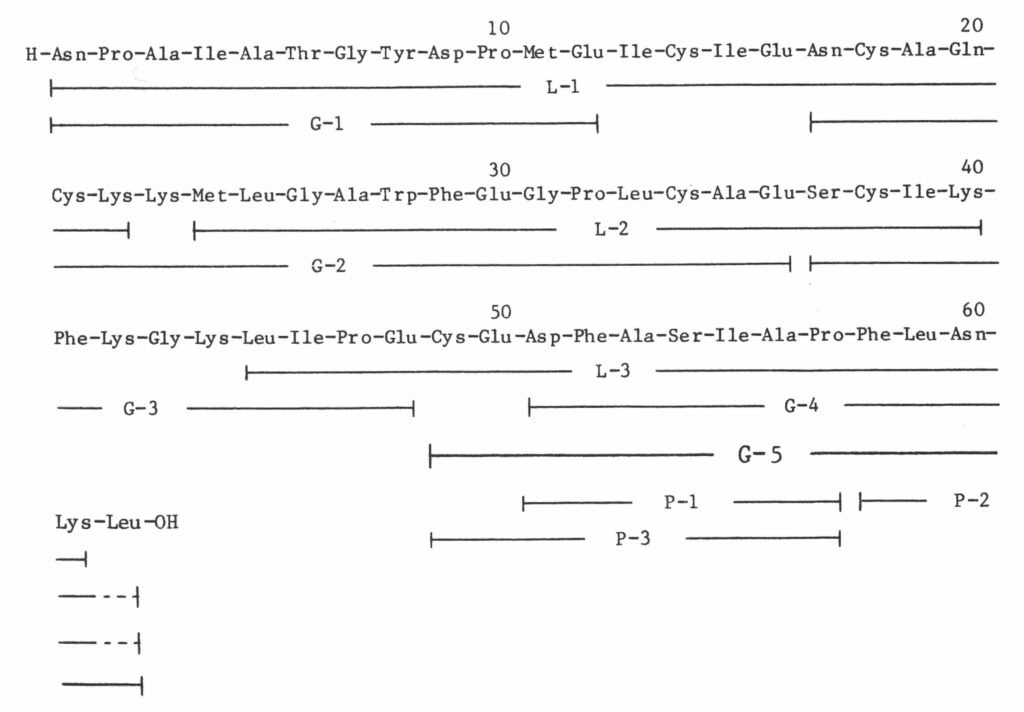
羽化ホルモン(Eclosion hormone、EH)(1)で紹介したように、EHの構造決定はpriolityを争う熾烈な競争であった。今回改めて論文(図1)を読み返して、当時の緊迫感を思い出すとともに、どんな実験を行ったか思い返すことができた。また、論文には書かれていないことがあることにも気づいた。以下にどんな実験を行ったか、まず概説する。
ペプチドホルモンの構造を明らかにするとは、アミノ酸配列を明らかにすることである。1万頭の頭部から単離できたEHは10μg(1.7 nmol)と微量であった。そのうちの1μgを使って、プロテインシーケンサーでアミノ酸配列分析したところ、アミノ(N)末端から35残基目までの配列が明らかになった(図2を参照)。ただし、システインとトリプトファン残基は(装置の特性から)同定できなかった。そこで、35残基までの配列の確認と残りのカルボキシル(C)末端側の配列を明らかにするため、2.5μg(400 pmol)のEHをリジルエンドペプチダーゼで消化した後に、そのチューブ内でカルキサミドメチル化してHPLCでフラグメントペプチドを分離・分取して配列分析を行った。一方、4μg(650 pmol)のEHを先にカルボキサミドメチル化し、6倍に希釈後に同じチューブ中でGlu-Cプロテアーゼで消化し、HPLCで分取したペプチド断片を配列分析した。その結果をまとめたものが図2「タバコスズメガEHのアミノ酸配列」である。2つの酵素分解フラグメントの配列分析で、システインとトリプトファン残基を含めて61残基目のリジンまでの配列を確定できた。62残基目のロイシンは、Glu-CプロテアーゼフラグメントのG-4とG-5がHPLCで同じピークとして溶出したこともあり、ロイシンがC末端であるかどうか明確にできなかった。そこで、G-4とG-5の混合物をプロリン特異的エンドペプチダーゼで消化し、3つのフラグメントP-1、P-2、P-3を得た。それぞれの配列分析ならびにアミノ酸分析値からP-2のみがプロリンを含まないことからC末端フラグメントであり、EHのC末端アミノ酸は62残基目のロイシンであると確定した。
ところで、ホルモンなどのペプチドはC末端がアミド化されたものが多い。そこで、C末端のロイシンがアミド化されているのか遊離型(カルボキシル基)なのかを明らかにしようと考えた。また、これを明らかにすることで、EHは62残基のペプチドであると断定できる。当時の通常のやり方だと、分子量が1,000以下のP-2ペプチドのFAB(Fast Atom Bombardment)質量分析を行い、アミド型と遊離型の分子量が1違うことを根拠に決めていた。さらに確実にするためには、P-2の配列をもつアミド型と遊離型の2つのペプチドを合成して、天然由来のP-2とHPLCの溶出位置や質量分析値を比較して、どちらが一致するかで確定していた。ところが、勤務していた研究所にはFAB質量分析装置がない、ペプチドを短期間で合成するための人手がない、との理由で上記の方法は断念せざるを得なかった。
そこで、研究所にある機器や技術でC末端アミノ酸がロイシンアミドか遊離型ロイシンかを明らかにできないかと数日間熟考した。思いついたのは、リジルエンドペプチダーゼで消化し、遊離するアミノ酸がロイシンアミドか遊離型ロイシンかを分析して証明しようという方法である。ロイシンアミドは試薬として(数日で)簡単に購入できる。アミノ酸の分析は、ペプチドをアミノ酸に加水分解した後にPTCアミノ酸へ誘導体化し定量する手法を研究所では普段から使っていた。また、L-3の分析でリジンまで検出でき、ロイシンは全く検出されなかった。つまり、リジルエンドペプチダーゼ処理すると61残基目のリジンのC末端側で切断される可能性が高いことを示している。一般的に、ペプチドをトリプシンなどで酵素分解した場合、切断部位の隣にあるのが1アミノ酸だけだと切断反応が起きない。リジルエンドペプチダーゼ特有の性質のおかげでこの実験が可能だったと考えられる。これらの状況を総合して、単離したEHそのものをリジルエンドペプチダーゼで消化して、C末端アミノ酸を遊離させ、そのアミノ酸を検出する方法で決定できると考えた。
単離した残り全量のEH 2.5μg(400 pmol)を使った実験結果は、PTC(遊離型)ロイシンが検出され、ロイシンアミドは検出されなかった。また、21残基目のリジン、41残基と42残基のジペプチド(Phe-Lys)、43残基と43残基のジペプチド(Gly- Lys)と思われるPTC誘導体が合わせて検出された。したがって、EHは62残基のペプチドでC末端は遊離型のロイシンであると結論できた。
では、現在ならどのような実験を行い構造決定するだろうか? マトリックス支援飛行型質量分析(MALDI TOF-MS/MS)で単離したEHを分析し、測定した解列パターンやMS/MSの結果を詳細に解析することで62残基目のロイシンまでの配列を一気に明らかにすることができる。さらに、その機器の精度からEHの分子量を1マス違いで決定できるために、遊離型であることも決定できる。しかも、分析には100分の1の0.1μgあれば十分である。技術革新を感じる。配列分析装置から得られたデータの目を皿にした解析など、自分や研究室が持っている技術を日々磨く必要がなくなったことが寂しい。ただ、ほぼ自動になったとはいえ、MALDI TOF-MS/MSの操作技術や解析技術がないと、簡単には構造決定できないと思う。
この研究結果はBBRCというそれほど著名でない科学雑誌に発表したが、私にとっては生涯で最も誇れる実験成果である。